Fitness First Göttingen - Wellness
Riesige Neuigkeiten, D-Friends: Das neue, schnell wirkende Inhalationsinsulin Afrezza hat gerade die FDA-Zulassung erhalten!
Das dritte Mal ist der Reiz für diese neue Formulierung von inhalierbarem Insulin, die zweite, die es nach dem gescheiterten Exubera von Pfizer vor mehr als einem Jahrzehnt durch den US-Zulassungsprozess geschafft hat.
Am Freitag erhielt das kalifornische Biotech-Unternehmen MannKind Corp. schließlich die Zulassung für sein Afrezza-Gerät.

Nach der erneuten Einreichung von Afrezza im Oktober 2013 hat MannKind die FDA endlich davon überzeugt, dass es bereit ist, in die Hände von Erwachsenen mit Diabetes zu gelangen!
Man sagt den führenden Führungskräften von MannKind, dass sie daran arbeiten, einen Pharmapartner für die Herstellung und den Vertrieb von Afrezza zu finden. Das Produkt könnte bereits im Januar oder Ende des ersten Quartals 2015 verfügbar sein. > In der am Freitag veröffentlichten Pressemitteilung der FDA erklärt Dr. Jean-Marc Guettier von der Abteilung für Metabolismus und Endokrinologie der Behörde: "Die heutige Zulassung erweitert die Möglichkeiten zur Verabreichung von Mahlzeiteninsulin in der Gesamtverwaltung von Patienten mit Diabetes, die diese benötigen um den Blutzuckerspiegel zu kontrollieren. "
Afrezza ist ein ultraschnell wirkendes Insulin in Pulverform, das als Insulin vor der Mahlzeit für Erwachsene entwickelt wurde (noch nicht für Kinder) ) mit Typ 1 oder Typ 2 Diabetes. Es ist auf Blutzuckerspitzen nach der Mahlzeit ausgerichtet, was bedeutet, dass es mit der bestehenden Insulinbehandlung verwendet wird und nicht als eigenständige Insulinbehandlung gedacht ist.
Das pulverisierte Insulin wird über einen pfeifenförmigen Inhalator namens Dreamboat verabreicht, der nach der ersten FDA-Runde entwickelt wurde und Verzögerungen verursachte, da die Behörde mehr klinische Studien mit diesem neuen Inhalator wünschte. Das Pulver löst sich sofort auf, wenn es in die Lunge eingeatmet wird, und das Insulin wird dann schnell in den Blutstrom abgegeben, um zu arbeiten. Afrezza erreicht innerhalb von 12 bis 15 Minuten den Höhepunkt und ist innerhalb einer Stunde aus dem System. Im Vergleich zu aktuellen Kurzzeit-Insulinen, die normalerweise mindestens 20 Minuten dauern, maximal 2-3 Stunden dauern und im System bleiben können lange als fünf Stunden.
Der größte Reiz ist natürlich, dass keine Nadeln erforderlich sind, sondern nur ein kleiner Handinhalator, der wirklich wie eine Pfeife aussieht.Das Dreamboat soll nach 15 Tagen weggeworfen werden, um zu verhindern, dass sich Pulveransammlungen im Gerät ansammeln, die das Gerät verstopfen könnten. Im Gegensatz zu herkömmlichem Insulin benötigt es keine Kühlung, sondern wird bei Raumtemperatur gehalten. Jede Einwegpatrone würde entweder 4 oder 8 Einheiten enthalten, und zu der Zeit, in der Afrezza vermarktet wird, könnte eine Patrone mit 12 Einheiten zur Verfügung stehen.
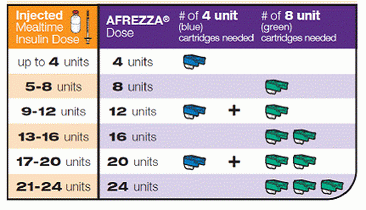
Hier können Sie wie folgt dosieren: Umrechnung der aktuellen Insulininjektions- oder Bolusmengen in eine Afrezza-freundliche inhalierbare Dosis:
Das scheint mir nicht viel Insulin zu sein, um einige der Mahlzeiten, die ich esse, zu decken höhere Dosen brauchen … Ich würde eine ganze Reihe dieser kleinen Patronen durchgehen. Für einige Menschen mit Behinderungen kann dieses Gerät eine logistische Herausforderung darstellen, wenn es darum geht, die benötigten Mengen einfach zu dosieren …? Aber auch dies kann ein gutes Mittel sein, um hartnäckige hohe Blutzuckerwerte mit Korrekturdosierung zu beseitigen.
In einem Telefongespräch am späten Freitag teilte uns MannKinds Präsident Hakan Edstrom mit, dass das Unternehmen noch keine Verträge mit potenziellen Partnern abgeschlossen hat, um Afrezza zu produzieren und zu vertreiben. Aber es kommt näher und in Gesprächen mit einer Reihe von Unternehmen wird eine Partnerschaft so schnell wie möglich abgeschlossen.
Die Kosten bleiben TBD (viel hängt von der potenziellen Partnerschaft ab), aber Edstrom sagt, sie erwarten, dass die Preise im gleichen Bereich liegen wie das, was wir Patienten in den USA normalerweise für Insulin-Pens bezahlenDiese Genehmigung ist eine RIESIGE Entwicklung, und es ist lange her, acht Jahre, seit diese Suche von Alfred Mann begonnen hat - dem Mann, der Minimed gründete, bevor es schließlich von Medtronic gekauft wurde. Wir verfolgen die Afrezza-Geschichte seit Jahren hier in der '
Mine - von den ersten FDA-Einreichungstagen, als MannKind sein anfänglich klirrigeres Design hatte, bis zu den jüngsten Berichten darüber, wie Afrezza in künstlichem Pankreas verwendet wird klinische Versuche.
Vor der Neuzulassung durch die FDA im vergangenen Herbst haben wir gehört, dass MannKind im vergangenen Sommer über klinische Phase-III-Studien mit 500+ Typ-1-PWDs in den USA und weltweit berichtete, was darauf hinwies, dass das Unternehmen bereit war, erneut mit der FDA zu verhandeln.
Der Beratungsausschuss, der am 1. April dieses Jahres zusammentrat, stimmte mit 13 zu 1 Stimmen dafür, dass Afrezza sicher und wirksam genug für die Zulassung zur Behandlung von Typ-1-Diabetes sei. Der einstimmige Abweichler David Cooke stimmte dafür, dass die Risiken die Vorteile für Typ überwogen 1s.Er wies auf den internen FDA-Review hin, der zeigte, dass einige Patienten, die Afrezza einnahmen, die Behandlung abbrachen, nachdem sie Bronchospasmen, Husten und eine Abnahme der Funktion ihrer Lungen entwickelt hatten. Aber keines dieser Bedenken wurde bei der Abstimmung über Afrezza für den Typ-2-Einsatz angesprochen, und der Ausschuss entschied einstimmig für eine 14-0-Abstimmung.

Sie wird nicht für Menschen mit Diabetes, die rauchen, oder zur Behandlung von diabetischer Ketoazidose (DKA) empfohlen.
Afrezza ist nur für Erwachsene zugelassen, nicht für Kinder. Die Agentur fordert jedoch eine klinische Studie nach dem Inverkehrbringen, um die Sicherheit und den Einsatz bei pädiatrischen Patienten zu bewerten.
- Die FDA verlangt eine "Boxed Warning", die darauf hinweist, dass einige Menschen mit Asthma und chronisch obstruktiver Lungenerkrankung (COPD), die Afrezza angewendet haben, akute Bronchospasmen hatten. Daher sollten Patienten mit chronischer Lungenerkrankung, Asthma oder COPD aufgrund dieses Risikos Afrezza nicht anwenden. Die häufigsten Nebenwirkungen, die in klinischen Studien mit Afrezza in Zusammenhang gebracht wurden, waren Hypoglykämie, Husten und Halsschmerzen oder Reizungen.
- Ein Teil der Genehmigungsanforderungen ist eine Risikobewertungs- und Risikominderungsstrategie, die einen Kommunikationsplan enthalten muss, um medizinisches Fachpersonal über das ernsthafte Risiko eines mit Afrezza verbundenen akuten Bronchospasmus zu informieren. Das bedeutet, dass der Nutzen die potenziellen Risiken der Verwendung von Afrezza überwiegt.
- Weitere Post-Market-Studien sind bei Afrezza erforderlich, z. B .: klinische Studie zur Bewertung des potenziellen Risikos einer pulmonalen Malignität unter Verwendung (diese Studie wird auch das kardiovaskuläre Risiko und die Langzeitwirkung von Afrezza auf die Lungenfunktion bewerten); und zwei pharmakokinetisch-pharmakodynamische euglykämische Glukose-Clamp-klinische Studien, eine zur Charakterisierung der Dosis-Wirkungs-Beziehung und eine zur Charakterisierung der Variabilität innerhalb des Subjekts.
- Edstrom sagte uns, dass sie planen, pädiatrische Studien so bald wie möglich zu beginnen, was realistisch irgendwann Mitte 2015 beginnen wird. Das bedeutet, dass Afrezza bis 2017 möglicherweise nicht für Kinder mit Diabetes zugelassen ist und dass der regulatorische Prozess variieren kann, je nachdem, was die Post-Marktstudien und die Erfahrungen mit Erwachsenen in der Zwischenzeit zeigen.
- Und trotz der grünen Ampel der FDA gibt es keine Garantie dafür, dass Afrezza kommerziellen Erfolg sehen wird oder dass Menschen mit eingeschränkter Mobilität dazu kommen werden, es zu benutzen. Wie bereits erwähnt, hat MannKind noch keine Pharmapartner für den Verkauf von Afrezza gewonnen. Aber wenn MannKind im Mai seine Gewinnzahlen bekannt gibt, ist das ein Hinweis darauf, was bald kommen wird. Eine mögliche Partnerschaft ist nicht weit entfernt.
Aus der Sicht des Investors sind viele skeptisch, was auf das gescheiterte Exubera-Inhalationsinsulin zurückzuführen ist, das in den letzten Jahren viel von der Diskussion über Afrezza geprägt hat. Dieses gemeinsame Produkt von Pfizer-Sanofi wurde 2007 nach mehr als einem Jahr unterdurchschnittlicher Verkäufe vom Markt genommen - was zu rekordverdächtigen 2 US-Dollar führte. 8 Milliarden Verlust für die Anbieter.
Natürlich behauptet MannKind, dass Afrezza sich signifikant unterscheidet, hauptsächlich weil Exubera einen klobigen, fußlangen Inhalator verwendet und mit einem höheren Lungenkrebsrisiko verbunden ist, das Pfizer nicht überwinden konnte.
Wir werden sehen, was die D-Community jetzt mit Afrezza denkt, besonders mit all den AP-klinischen Studien, die sie in letzter Zeit erhalten hat. Ob das ausreicht, um die Massen zu überzeugen, ist noch unklar …
Atmen Sie die Nachrichten für jetzt ein, und wir werden sehen, wie lange es dauert, bis wir alle ausatmen und diese Aufregung in tatsächliche Verkäufe und weit verbreitete Verwendung verwandeln.
Disclaimer
: Inhalt, der vom Team der Diabetes Mine erstellt wurde. Für mehr Details klicken Sie hier.
Haftungsausschluss Dieser Inhalt wurde für Diabetes Mine erstellt, ein Verbrauchergesundheitsblog, der sich auf die Diabetes-Community konzentriert. Der Inhalt wird nicht medizinisch überprüft und entspricht nicht den redaktionellen Richtlinien von Healthline. Für weitere Informationen über die Partnerschaft von Healthline mit der Diabetes Mine, klicken Sie bitte hier.Inhaliert Insulin und Afrezza: Was Sie wissen sollten

DiabetesMine erklärt die Geschichte von inhalierbarem Insulin bei Diabetes, den Status von Afrezza und mehr.
Inhaliert Insulin Exubera wird erneuert | DiabetesMine

Dance Pharmaceuticals entwickelt mit einem Team, zu dem auch ehemalige Pfizer-Entwickler gehören, ein aktualisiertes Insulin, das sich von MannKinds Afrezza unterscheidet.
Afrezza, Afrezza 4 Einheit (30) - 8 Einheit (60), Afrezza 4 Einheit (60) - 8 Einheit (30) (Insulin (Inhalation)) Nebenwirkungen, Wechselwirkungen, Verwendungen & Drogenabdruck

Arzneimittelinformationen zu Afrezza, Afrezza 4 Einheiten (30) - 8 Einheiten (60), Afrezza 4 Einheiten (60) - 8 Einheiten (30) (Insulin (Inhalation)) enthalten Arzneimittelbilder, Nebenwirkungen, Arzneimittelwechselwirkungen, Gebrauchsanweisungen, Symptome einer Überdosierung und was zu vermeiden ist.




