Fitness First Göttingen - Wellness
Inhaltsverzeichnis:
- Was ist ein Hybrid-Closed-Loop?
- Äußerlich sieht der Minimed 670G fast identisch mit dem kürzlich zugelassenen Minimed 630G des Unternehmens aus, der das Medtronic Standard-Pumpendesign um eine neue vertikale Ausrichtung und Farbdisplay erweitert.
- Aufgrund der viel schneller als erwarteten Zulassung hat Medtronic mitgeteilt, dass sie mindestens sechs Monate für die Produkteinführung in den USA ab Frühjahr 2017 benötigen. Für diejenigen außerhalb der USA, so Medtronic voraussichtlich Mitte 2017 eine Zulassung erwarten.
- Der JDRF gab am Mittwoch eine Pressemitteilung heraus, in der er sich über diese bahnbrechende Technologie und die schnelle Entwicklung der FDA äußerte. Die American Diabetes Association stimmte ebenfalls mit einer Pressemitteilung zu dieser Zulassung überein und wies auf ihre Bedeutung hin.
- Es ist erwähnenswert, dass die FDA am Mittwoch auch das Abbott Freestyle Libre Pro-System hier in den USA grünes Licht gegeben hat
- Dieser Inhalt wurde für Diabetes Mine erstellt, ein Verbrauchergesundheitsblog, der sich auf die Diabetes-Community konzentriert. Der Inhalt wird nicht medizinisch überprüft und entspricht nicht den redaktionellen Richtlinien von Healthline. Für weitere Informationen über die Partnerschaft von Healthline mit der Diabetes Mine, klicken Sie bitte hier.
Wow, was für ein großer Moment für die Diabetes Community!
Am Mittwoch hat die FDA das Minimed 670G von Medtronic zugelassen, das erste "hybride System mit geschlossenem Regelkreis", das bei Patienten ab 14 Jahren mit Typ-1-Diabetes Glukose automatisch überwachen und Basalinsulindosen anpassen kann.

Während wir in der Diabetes Community feststellen, dass es kein komplett geschlossener AP ist, der die Kontrolle über den Diabetes vollständig übernimmt, und Medtronic selbst ist vorsichtig, es als "Hybrid" zu bezeichnen, das neue Minimed 670G ist ein großer Schritt zur Automatisierung unseres Krankheitsmanagements. Woot!
Hier ist der offizielle Brief der FDA an Medtronic über diese Freigabe sowie die FDA-Pressemitteilung.
Bemerkenswert ist, dass diese Zulassung nur 104 Tage (!) Beträgt, nachdem Medtronic tausende Seiten Dokumente eingereicht hat, was sieben Monate früher als erwartet ist und diese Genehmigung mehr als ein Jahrzehnt Forschung, Politik, und Produktentwicklung, um diesen Meilenstein zu erreichen.
"Das ist phänomenal und ich bin so begeistert! "Sagt Aaron Kowalski, Chief Mission Officer des JDRF und langjähriger Typ 1 selbst. "Es ist unglaublich, auf diesem Niveau zu sein. Denken Sie darüber nach - dies ist das erste Mal, dass eines dieser (automatisierten Systeme) genehmigt wurde … und die kurze Zeit, die die FDA brauchte, um dies zu klären. "
Also, Was ist das neue Blutzuckerkontrollsystem und wie funktioniert es?
Was ist ein Hybrid-Closed-Loop?
Der Begriff "Hybrid" bedeutet in diesem Fall, dass das System teilweise automatisiert ist, aber immer noch eine gewisse Kontrolle durch den Benutzer erfordert.
Die Funktionsweise des CGM-Sensors besteht darin, dass der CGM-Sensor alle fünf Minuten Glukosedaten liest. Der in der Pumpe integrierte Regelungsalgorithmus verwendet diese Informationen, um Basalinsulin zu erhöhen oder zu senken, um den Glukosespiegel so nahe wie möglich am Ziel von 120 zu halten mg / dl. Benutzer müssen noch Kohlenhydrate und Bolusbeträge für Mahlzeiten eingeben und das System vor jeder Übung warnen.Es gibt auch keine automatischen Korrekturbolus basierend auf CGM, aber es schlägt Korrekturbeträge vor, wenn ein Fingerspitzenergebnis ist wie alle Standard-Insulinpumpen jetzt über die Bolus-Wizard-Funktion eingegeben werden.
< ! --1 ->Diese FDA-Seite macht einen guten Job und erklärt die Details. Das MiniMed 670G System verfügt über zwei Modi, einen "Autopiloten" mehr als den anderen, aber beide erfordern einen Benutzereingriff (also keine vollständig geschlossene Schleife):
Manueller Modus - in dem das System durch die Programmierung programmiert werden kann Benutzer, Basalinsulin mit einer vorprogrammierten konstanten Rate zu liefern.Das System unterbricht automatisch die Abgabe von Insulin, wenn der Glukosewert des Sensors unter einen vorbestimmten Schwellenwert fällt oder vorhergesagt wird. Das System wird die Insulinabgabe automatisch wieder aufnehmen, sobald die Glukosewerte des Sensors über einen vorbestimmten Schwellenwert ansteigen oder vorhergesagt werden.
Auto-Modus - Das System kann das Basalinsulin automatisch einstellen, indem es die Insulinabgabe basierend auf CGM-Werten kontinuierlich erhöht, verringert oder aussetzt (anders als im manuellen Modus, bei dem Basalinsulin konstant abgegeben wird) Bewertung). Obwohl der Auto-Modus die Basalinsulinabgabe automatisch ohne Eingabe durch den Benutzer anpassen kann, muss der Benutzer während der Mahlzeiten immer noch manuell Insulin abgeben.
Minimed 670G Produktmerkmale
Äußerlich sieht der Minimed 670G fast identisch mit dem kürzlich zugelassenen Minimed 630G des Unternehmens aus, der das Medtronic Standard-Pumpendesign um eine neue vertikale Ausrichtung und Farbdisplay erweitert.
Der große Unterschied besteht darin, dass diese Kombination aus Insulinpumpe und CGM von einem ausgefeilten Algorithmus gesteuert wird. Medtronic verwendet die "SmartGuard Hybrid Closed Loop" -Technologie, die diese automatischen Anpassungen des Basalinsulins und die automatische Abschaltung bei Bedarf ermöglicht. Die Produktspezifikationen lauten wie folgt:

Pumpeneinheit:
- Wie bereits erwähnt, ist das Aussehen identisch mit dem Minimed 630G, der erst letzten Monat eingeführt wurde (bereits veraltet?). Die gleiche AA-Batterie, die gleichen Infusionssets und das Insulinreservoir mit 300 Einheiten sind ein wenig größer als die herkömmlichen Minimed-Pumpen mit ihrer horizontalen Ausrichtung. Im Gegensatz zu älteren Medtronic Pumpen wird dieses Gerät nur in Schwarz angeboten, aber Sie können eine Reihe von verschiedenen Skins kaufen, um das Aussehen aufzumotzen, wenn Sie es wünschen. Tasten und Menüs:
- Die einzigen kleinen Unterschiede zwischen dem 630G und dem neuen MiniMed 670G sind die Tatsache, dass Sie mit der oberen rechten Taste direkt zu CGM-Graphen gelangen, im Gegensatz zum Menüpfad aufgrund der neuen Modusoptionen usw. auf dem neuen System. Farbdisplay:
- Wie das 630G verfügt auch das neue System über einen hellen Vollfarbbildschirm (!), Der sich automatisch an Lichtsituationen anpasst, so dass er beispielsweise nachts nicht so hell aufleuchtet während des Tages. Dies scheint viel einfacher zu lesen, ein großer Vorteil für Menschen mit Sehbehinderungen natürlich. Neben den grundlegenden Pump- und CGM-Daten wird Insulin on Board (IOB) direkt auf dem Homescreen angezeigt - etwas, nach dem Benutzer gesucht haben. CGM Tech:
- Das neue System verwendet den CGM-Sensor der vierten Generation von Medtronic, der als Enlite 3 bezeichnet wurde, jetzt aber als Guardian 3-Sensor bekannt sein wird ( haben wir einen Ablauf von all die verschiedenen Medtronic Begriffe über Storify ). Es wird von der FDA freigegeben, um den Körper für 7 Tage im Vergleich zu 6 Tagen für frühere Generationen zu tragen.Auf der Klebefront ist nichts Neues. Verbesserte Genauigkeit:

- Der Guardian 3 ist zuverlässiger und genauer, da Medtronic ein neues Funksignal (mit dem 630G eingeführt) für die Kommunikation zwischen Sender und Sensor verwendet. Laut den klinischen Zulassungsdaten des Unternehmens bei zwei Kalibrierungen pro Tag liegt die MARD-Fehlerrate im Durchschnitt bei 10,5%, was nicht so gut ist wie beim letzten Dexcom G5 bei 9%, aber viel besser als die ~ 14% aktuelle Enlite zu bieten hat - das ist ein potenzieller Spielmacher, Medtronic zu einem stärkeren Mitbewerber auf dem CGM-Markt zu machen! Ihr Modus kann variieren:
- Medtronic sagt, er habe den Leuten zugehört, dass sie die Wahl haben wollen. Es ist also möglich, zwischen den Modi zu wechseln: Auto-Modus für die hybride Closed-Loop-Funktion oder Manueller Modus, der weiterhin die Suspend-Funktion bietet Wenn Sie diese Hyposchwelle (wie die 530G und 630G beide haben) überschritten haben, können Sie den Suspend Pre Before Low-Wert einstellen, um Hypos 30 Minuten vor ihrem Auftreten vorherzusagen (wie beim international verfügbaren 640G). Set BG Target:

- Diese Technologie wurde entwickelt, um "to-target" zu behandeln. Dies bedeutet, dass die BGA-Werte so nahe wie möglich bei 120 mg / dL gehalten werden. Leider kann das nicht geändert werden … was bedeutet, dass Medtronic bisher nur die "Personalisierung und Anpassung" übernimmt. Der Benutzer kann ein temporäres Ziel von 150 mg / dL für bis zu 12 Stunden einstellen, um mit Situationen wie Bewegung umzugehen, aber das ist die einzige eingebaute Flexibilität. Medtronic sagt, dies sei das Ergebnis des Versuches, zuerst auf den Markt zu kommen, weil verschiedene Ziele zugelassen würden bedeuten viel größere klinische Studien, die die Zulassung und Vermarktung der Zulassung verzögert hätten. Zukünftige Generationen werden wahrscheinlich unterschiedliche Zielwerte erlauben, sagt Medtronic.
- Wie das frühere Minimed 630G System verfügt diese 670G Hybrid Closed Loop über kein integriertes Bluetooth und funktioniert nicht mit Minimed Connect für die gemeinsame Nutzung von Mobiltelefonen ( ?!). Für diejenigen, die Daten teilen möchten, zeigt Medtronic die Menschen auf ihr Minimed 530G-System, das jetzt mehr als drei Jahre alt ist. Aufgrund dieser fehlenden Konnektivität wird der 670G mit keiner der in Entwicklung befindlichen IBM Watson- oder mobilen Anwendungen mit gemeinsamer Datennutzung zusammenarbeiten.
- Das System ist so eingestellt, dass es direkt mit dem Bayer Contour Link 2 kommuniziert. 4 Meter, das Ascensia mit der Startankündigung 630G eingeführt hat. Dies ermöglicht das Remote-Bolusing vom Messgerät, jedoch nur im manuellen Modus und nicht im automatischen Modus mit geschlossenem Regelkreis. Zwei Kalibrierungen täglich:
- Das System benötigt mindestens alle 12 Stunden mindestens eine Fingerstichkalibrierung, und wenn es nicht eingegeben wird, wird der Benutzer automatisch aus dem Automatikmodus genommen.
- Der 670G verwendet den neuen One-Press-Ser- ter von Medtronic, mit dem die Sensoreingabe einfacher und komfortabler wird. Es erfordert nur eine einzige Taste drücken, im Vergleich zu der vorherigen Generation serter, die voluminöser war und zwei Tastendrücke (einmal zum Einfügen und einmal zum Zurückziehen) benötigt. Kinder und Jugendliche:
- Minimed 670G ist offiziell für Kinder ab 14 Jahren zugelassen, aber das Unternehmen sagt, es führt bereits Studien für die Zulassung bei Kindern zwischen 7-13, sowie Machbarkeitsstudien für Jugendliche ab 2 Jahren. Der aktuelle FDA-Zulassungsbescheid besagt ausdrücklich, dass der 670G nicht bei Patienten unter 7 Jahren oder bei Patienten mit weniger als 8 Einheiten Insulin pro Tag angewendet werden sollte (da das Gerät dieses Minimum pro Tag für einen sicheren Betrieb benötigt). Metronic sagt, dass es bei denjenigen, die weniger als 8 Einheiten pro Tag nehmen, nicht genug Daten hat, um zu wissen, ob der Algorithmus effektiv und sicher ist. Verfügbarkeit und Kosten
Aufgrund der viel schneller als erwarteten Zulassung hat Medtronic mitgeteilt, dass sie mindestens sechs Monate für die Produkteinführung in den USA ab Frühjahr 2017 benötigen. Für diejenigen außerhalb der USA, so Medtronic voraussichtlich Mitte 2017 eine Zulassung erwarten.
Es gibt viele "bewegliche Teile", die vor dem Start hier in Amerika installiert werden müssen, erklären sie, und sie befinden sich derzeit inmitten des Minimed 630G-Starts. Dieses Vorgängermodell wurde erst kürzlich an Patienten in den USA ausgeliefert.
Ja, es wird einen Upgrade-Weg für jeden geben, der aktuelle Medtronic-Produkte verwendet - das Priority Access Program. Es ermutigt die Kunden, in den kommenden Monaten auf der Minimed 630G zu starten, bevor die 670G auf den Markt kommt, und weist darauf hin, dass ein solcher Übergang den Patienten helfen wird, für die neue Plattform zu trainieren und ihre Auslagenkosten auf bis zu $ 0 zu senken.
Priority Access-Programm Anfangskosten = $ 799
- Trade-in-Guthaben bei MiniMed 630G-Pumpe & CGM-System = $ 500
- Gesamtkosten für Out of Pocket = nur $ 299
- Teilnahme an Umfragen und anderen Benutzer-Feedback-Programmen können reduzieren Sie auch diese Kosten, um so niedrig wie $ 0 für einige Leute zu sein, stellt das Unternehmen
- das prioritäre Zugangsprogramm läuft durch 28. April 2017 fest. Medtronic sagt auch, dass mehr Angebote und Aufrüstungsmöglichkeiten näher zur Startzeit im Frühling aufgedeckt werden können.
Natürlich wird Medtronic in den kommenden Monaten auch mit Kostenträgern und Versicherungen für diese Technologie arbeiten. Angesichts der jüngsten Kontroversen über diese Probleme (#DiabetesAccessMatters) hoffen wir, dass Medtronic sich bewusst ist, dass zwar viele Patienten dieses System wünschen, es aber möglicherweise nicht die beste Wahl für alle - und Auswahlfragen ist!
'Ein Wendepunkt-Moment … Die Transformation der Diabetes-Versorgung'
Der JDRF gab am Mittwoch eine Pressemitteilung heraus, in der er sich über diese bahnbrechende Technologie und die schnelle Entwicklung der FDA äußerte. Die American Diabetes Association stimmte ebenfalls mit einer Pressemitteilung zu dieser Zulassung überein und wies auf ihre Bedeutung hin.
Denken Sie darüber nach: Vor zehn Jahren dachten viele noch, dass ein geschlossenes Regelkreis-System ein Wunschtraum sei. Aber JDRF legte eine echte Blaupause auf dem Weg zu einer künstlichen Bauchspeicheldrüse. Das waren noch die frühen Tage der CGM-Technologie … und schau, wie weit wir gekommen sind!
"Das hat unglaublich schnell geklappt, und es zeigt, wie wichtig die harte Arbeit war, die wir heute auf der politischen Seite geleistet haben, um eine Anleitung für diese Systeme zu schaffen", sagte Kowalski, der persönlich spielte eine wichtige Rolle dabei, AP-Tech-Entwicklung zu einer Priorität zu machen."Das hat alles verändert und einen Weg geschaffen, und jetzt sind wir hier. Es ist massiv, wirklich ein Wendepunkt, der das Potenzial hat, die Diabetes-Versorgung zu verändern!"Tatsächlich hat die FDA die Zulassung für diesen Minimed 670G erteilt, während zusätzliche Post-Market-Studien erforderlich waren, um besser zu verstehen, wie das Gerät in der Praxis funktioniert. Das zeigt, dass die FDA bereit ist, bestehende Daten zu prüfen und auf die Vorteile zu vertrauen, ohne sich auf riesige Mengen zukünftiger Daten zu beschränken.

Wir haben auch mit Jeffrey Brewer gesprochen, der Bigfoot Biomedical leitet, der sein eigenes Closed-Loop-System entwickelt, das voraussichtlich 2018 verfügbar sein wird. Zusammen mit Aaron Kowalski gilt Brewer als einer der "Väter des AP" Angesichts ihrer Rolle bei der Entwicklung und Förderung des geschlossenen Kreislaufs im JDRF.
Zweifelsohne bewegt dies die Nadel auf den mehr als 18 anderen Systemen mit geschlossenem Regelkreis nach vorne - insbesondere jene, die nur Insulin verwenden. Einige fügen das zusätzliche Hormon Glucagon zu der Mischung hinzu, um Hypoglykämie zu bekämpfen (wie Beta Bionics iLET und Pancreum Genesis), was mehr FDA-Evaluierungszeit erfordern kann.
Es ist großartig zu sehen, dass sich die FDA so schnell bewegt, nicht nur mit dieser Minimed 670G-Zulassung, sondern auch mit anderen aufregenden Diabetes-Tech- und Datenentwicklungen der letzten Jahre. Offensichtlich erkennt die FDA die #WeAreNotWaiting-Bewegung an und tut ihr Bestes, um mit diesen schnelllebigen Zeiten Schritt zu halten.
FDA genehmigt Libre Pro
Es ist erwähnenswert, dass die FDA am Mittwoch auch das Abbott Freestyle Libre Pro-System hier in den USA grünes Licht gegeben hat
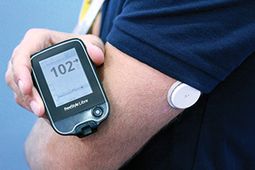
Auch als "hybrides System" bezeichnet - aber nur für die Glukoseüberwachung - besteht Abbott Libre aus einem kleinen runden Sensor, der bis zu 14 Tage lang auf der Rückseite des Oberarms getragen wird, und einem Controller, den die Benutzer gerade wischen darüber hinaus so oft wie nötig oder gewünscht, um kabellose Blutzuckermesswerte zu erhalten.
Es gibt keine Alarme für steigende oder fallende Blutzuckerwerte, und die Verbraucherversion im Ausland speichert nur 8 Stunden Daten.Das Ziel ist es, eine einfachere Überwachungslösung zu schaffen, die auch vielen Typ-2-Patienten hilft, in Echtzeit mit ihrem Glukosespiegel in Kontakt zu kommen.
Obwohl es sich bei Abbott nicht um eine traditionelle CGM handelt, wie wir sie kennen, sagt Abbott, dass die regulatorischen Regeln Libre als CGM einstufen. Und was sie jetzt genehmigt haben, ist eine Version, die speziell für Ärzte entwickelt wurde, um sie ihren Patienten für den kurzfristigen Gebrauch zur Verfügung zu stellen, und sie liefert nur geblendete Daten für die Ärzte. Dies ist ein erster Schritt in Richtung der Verbraucherversion, für die Abbott kürzlich in den USA eine FDA-Zulassung beantragt hat.
Hoffentlich wird das bald kommen, mit der scheinbar beschleunigten Innovation der FDA.
Ein großes Dankeschön an alle Beteiligten - nicht zuletzt an die FDA -, dass wir diese wichtigen Diabetes-Behandlungsinstrumente in unserem besten Interesse vorangebracht haben!
Disclaimer
: Inhalt, der vom Team der Diabetes Mine erstellt wurde. Für mehr Details klicken Sie hier. HaftungsausschlussDieser Inhalt wurde für Diabetes Mine erstellt, ein Verbrauchergesundheitsblog, der sich auf die Diabetes-Community konzentriert. Der Inhalt wird nicht medizinisch überprüft und entspricht nicht den redaktionellen Richtlinien von Healthline. Für weitere Informationen über die Partnerschaft von Healthline mit der Diabetes Mine, klicken Sie bitte hier.
NEWS FLASH: Abbott Navigator Genehmigt von der FDA

Werfen Sie einen genaueren Blick auf Medtronic Minimed 670G | DiabetesMine

Dubois schließt seine dreimonatige Studie zu Medtronic's neuer Hybrid-Closed-Loop-Diabetes-Technologie ab und hat einige Meinungen zu diesem Gerät.
Diabetes Produkttest: Medtronic 670G Hybrid Closed Loop

DiabetesMine testet den neuen Minimed 670G Hybrid-Regelkreis von Medtronic Diabetes - ein System der ersten Generation der künstlichen Pankreas-Technologie.




