Fitness First Göttingen - Wellness
Inhaltsverzeichnis:
- So wie wir über ein weiteres Jahr kicherten, ohne dass diese schwer fassbaren "All-in-One" -Meter auf den Markt kamen … Bam! Ein paar Tage vor Weihnachten hat die FDA das Dario-Messgerät von LabStyle Innovations aus Israel genehmigt, das seit Anfang 2014 unter behördlicher Aufsicht steht. Wir haben das Gerät schon früher behandelt und waren aufgrund der traditionellen Zurückhaltung der FDA nicht auf der Hut genehmigen diese Art von Zählern. Es scheint, dass die Gezeiten sich jetzt gewendet haben und wir sind gespannt darauf, Dario bald in den USA leben zu sehen.
- Dexcom:
- Sie können so viel oder so wenig wie Sie möchten, machen es zu einem potenziellen Weg, um die Notwendigkeit für teure Teststreifen zu beseitigen, ohne auf ein vollständiges CGM-Gerät zu verpflichten, wenn Sie es wünschen.
- Tandem Diabetes Care
Es ist eine Neujahrstradition hier in der 'Mine, um auf die neuen Behandlungen und Technologien zu schauen, von denen wir erwarten, dass sie den Hecht im nächsten Jahr erreichen werden. Das Jahr 2016 beginnt mit einem Paukenschlag mit der gestrigen Ankündigung, dass Sanofi MannKinds Afrezza Insulin inhaliert - wow!

(Falls Sie neugierig auf unsere vorherigen
Vorhersagen sind, können Sie auf unsere Berichte für 2014 und 2015 zurückblicken.) Afrezza Adrift, Unter Insulinkriegen
Leider begann dieses Jahr mit den Nachrichten am Dienstag, dass Sanofi seine Zustimmung zu MannKind Co rp gekündigt hatte. Arezza inhalatives Insulin herzustellen und zu verkaufen. Der Umsatz ist seit Anfang 2015 nach der FDA-Zulassung im Jahr zuvor enttäuschend, und Gerüchte über den Rückzug von Sanofi kursieren seit Monaten.

Wir hoffen wirklich, dass er Recht hat, weil viele PWDs (einschließlich
'Mine Redakteur AmyT und meine eigene Mutter, die mit T1D lebt) haben Afrezza im vergangenen Jahr benutzt und geliebt. Jetzt könnte die Afrezza-Ära sehr bald zu einem vorzeitigen Ende kommen … wir werden sehen. Die Ungewissheit um inhalatives Insulin bleibt indes nur ein Teil der anhaltenden Insulinkriege, die unter den Big Three-Herstellern - Eli Lilly, Novo Nordisk und Sanofi - weitergehen und sich 2016 nur verstärken werden, wenn sie sowohl Insulin als auch Insulin bekämpfen andere neue, wettbewerbsfähige Diabetes-Medikamente.
Sanofi:
Abgesehen von den Afrezza-Nachrichten kam Sanofis neues hochkonzentriertes U-300-Basalinsulin Toujeo ("der Sohn von Lantus") im vergangenen Jahr auf den Markt, was zu Aufregung und Verwirrung bei der Dosierung führte Umwandlung. Jetzt setzt Sanofi 2016 seinen Fokus auf GLP-1-Agonisten und GLP-1 / Basalinsulin-Kombinationsmedikamente hier in den USA.Im September haben sie eine FDA-Zulassung für Lyxumia (Lixisenatid) beantragt. Dies ebnet den Weg für die Kombination Droge Lixilan (Lyxumia + Lantus) einmal genehmigt.
Novo:Das neue lang anhaltende Basalinsulin Tresiba aus New Jersey kam 2015 auf den Markt und hat sich gegen Sanofis Toujeo durchgesetzt. Novo entwickelt auch eine schneller wirkende Version von Novolog, die bisher keinen anderen Namen als den Namen NN11218 für klinische Studien hat. Novo hat klinische Phase-III-Studien mit diesem Medikament abgeschlossen und hofft, es 2016 auf den Markt bringen zu können.
Mitte Dezember hat die FDA ihr neues Basalinsulin Basaglar, das als preisgünstigere Version von Sanofis Lantus gilt und seit einem Jahrzehnt den Markt dominiert, zugelassen. Lilly hat erklärt, dass Basaglar Ende 2016 marktreif sein wird. Natürlich müssen sie auch mit Toujeo und Tresiba konkurrieren, also erwartet Marketing-Kriege, Insulin-Nutzer!
So wie wir über ein weiteres Jahr kicherten, ohne dass diese schwer fassbaren "All-in-One" -Meter auf den Markt kamen … Bam! Ein paar Tage vor Weihnachten hat die FDA das Dario-Messgerät von LabStyle Innovations aus Israel genehmigt, das seit Anfang 2014 unter behördlicher Aufsicht steht. Wir haben das Gerät schon früher behandelt und waren aufgrund der traditionellen Zurückhaltung der FDA nicht auf der Hut genehmigen diese Art von Zählern. Es scheint, dass die Gezeiten sich jetzt gewendet haben und wir sind gespannt darauf, Dario bald in den USA leben zu sehen.

Dexcom:
Wir sind nur ein paar Monate nach der mit Spannung erwarteten Markteinführung des G5, bei dem kein separater Receiver mehr benötigt wird -zu-Smartphone-Fähigkeit, aber es kommt bald mehr. Steven Pacelli, Vizepräsident für Strategie und Unternehmensentwicklung bei Dexcom, sagt, die Gewinnausschreibungen hätten alle Hinweise enthalten, die das Unternehmen an dieser Stelle öffentlich bekannt geben könne. Von dem, was wir ablesen können, zeichnet sich für die kommenden Monate ein großer Fortschritt ab: Android-Kompatibilität für das G5, die bisher nur für iPhones gilt
- Weitere Fortschritte bei der Integration der Apple Watch kommen Demnächst können G5-Benutzer ihre eigenen Daten auf dem Watch
- ansehen. Ein neues Ein-Tasten-Einfügegerät wird voraussichtlich Mitte 2016 erwartet.Von Prototypbildern, die wir gesehen haben, scheint es dem Medtronic Enlite-Sensoreinsetzer zu ähneln, der mit einer Hand bedient werden kann
- Reduzierter G5-Sender, der kompakter als der aktuelle G5 und sogar kleiner als das vorherige G4-Modell ist
- Am aufregendsten? Dexcom plant, in den kommenden Monaten noch den Next-Gen-G6 abzufertigen, was bei CGM-Technologie mit 10 Tagen Abnutzung anstelle der aktuellen 7 ein wahrer Sprung nach vorne ist, nur eine Kalibrierung statt zwei, und verbesserte Genauigkeit und Zuverlässigkeit.
Dexcom sagt, dass es die G6 bis April einreichen wird, und plant für 2017 eine Einführung. Aber in der Vergangenheit hat sich die FDA überraschend schnell auf Entwicklungen von Dexcom bewegt, also könnten wir vielleicht vor Ende 2016 einen G6-Start für Erwachsene und Kinder sehen. Das mag optimistisch sein, aber es scheint uns im Bereich der Möglichkeiten zu liegen.

Neue Geräte von MedT werden in den nächsten 12 Monaten möglicherweise nicht auf den Markt kommen, aber es wird wahrscheinlich ein großes Jahr des Fortschritts bei der Entwicklung von Next-Gen-Technologien und -Teilen sein.
Glooko wird bald seine Plattform mit Medtronic-Daten ausstatten, und das neue Minimed Connect-System soll bald Android-kompatibel sein. Medtronic-Sprecherin Amanda Sheldon sagt, das Unternehmen plant, Anfang 2016 sein Minimed 640G-System einzureichen. Das Gerät ist seit einem Jahr im Ausland erhältlich und klinische Versuche werden hier im U
abgeschlossen. S., so, während dieses Gerät nicht rechtzeitig für einen Start 2016 freigegeben werden kann, ist die Einreichung an sich ein wichtiger Schritt nach vorn. Der 640G wird eine völlig neue, elegante, moderne Optik und vertikales Design haben, verglichen mit dem horizontalen Design und dem Langzeit-Look dieser Pumpen.
Wie sein Vorgänger, der 530G, kann das Gerät bei einem niedrigen Blutzucker automatisch Insulin abschalten. Es wird aber auch möglich sein,
vorher vorherzusagen und die Dosierung auszusetzen, um die Tiefs tatsächlich zu verhindern, was der aktuelle 530G erst schaffen kann, wenn Sie eine niedrige Schwelle überschritten haben. Der 640G wird einen Sensor der vierten Generation, den Enlite 3, enthalten - die nächste Generation, die über das derzeit in Europa verfügbare Enlite 2 oder Enhanced Enlite hinausgeht. Sheldon sagt, dass die 640G klinischen Studien im Alter von 14 Jahren und älter durchgeführt wurden, so dass es zumindest pädiatrischer sein wird als das, was MedT typischerweise mit seiner neuesten Technologie hatte. Wir haben bereits im September 2013 nach der pädiatrischen Bezeichnung für die aktuelle Minimed 530G Pumpe-CGM Combo gefragt, aber MedT hat dies immer noch nicht durch die FDA bekommen und hat keine geplante Zeitplanung. Enttäuschend zu hören, wie es junge Leute zwingt auf den 640G zu warten.
In der Zukunft verstehen wir, dass der Minimed 670G ein hybrides System mit geschlossenem Regelkreis sein wird, das Medtronic von Anfang an in allen Altersgruppen untersuchen will. Diese Zukunftstechnologie wird irgendwann in 2017-18 projiziert.
Abbott Freestyle Libre
Viele Fachbeobachter und Experten erwarten, dass Abbotts neuartiges FreeStyle Libre Flash-Glukose-Monitoring (FGM) im Jahr 2016 oder kurz danach in die USA kommt.Dieses System kombiniert Fingerstech-Tests und existierende CGM (kontinuierliche Glukoseüberwachung) mit einer Prise nicht-invasiver Technologie. Das heißt, es besteht aus einem kleinen runden weißen Sensor, der auf der Haut getragen wird, und einem "Empfänger", der einem handgehaltenen PDM ähnelt, den Sie über den Sensor schwenken, um die Glukosewerte kabellos aufzunehmen.
Sie können so viel oder so wenig wie Sie möchten, machen es zu einem potenziellen Weg, um die Notwendigkeit für teure Teststreifen zu beseitigen, ohne auf ein vollständiges CGM-Gerät zu verpflichten, wenn Sie es wünschen.
Der Libre ist seit einem Jahr in Übersee erhältlich und erhält überwiegend positives Feedback. Während Abbott nicht speziell zu einer Zeitlinie für die USA kommentiert, bestätigt es Pläne, es auf der Grundlage der Pro-Version, die es bereits bei der FDA eingereicht hat, auf den US-amerikanischen Stand zu bringen. Es gibt auch eine pivotale Studie, die letztes Jahr für die Personal-Version abgeschlossen wurde, und eine PR-Agentur für Abbott sagt uns, dass das Unternehmen "positive Gespräche mit der FDA geführt hat und durch die Genehmigung des Plans für eine weitere klinische Studie ermutigt wird."
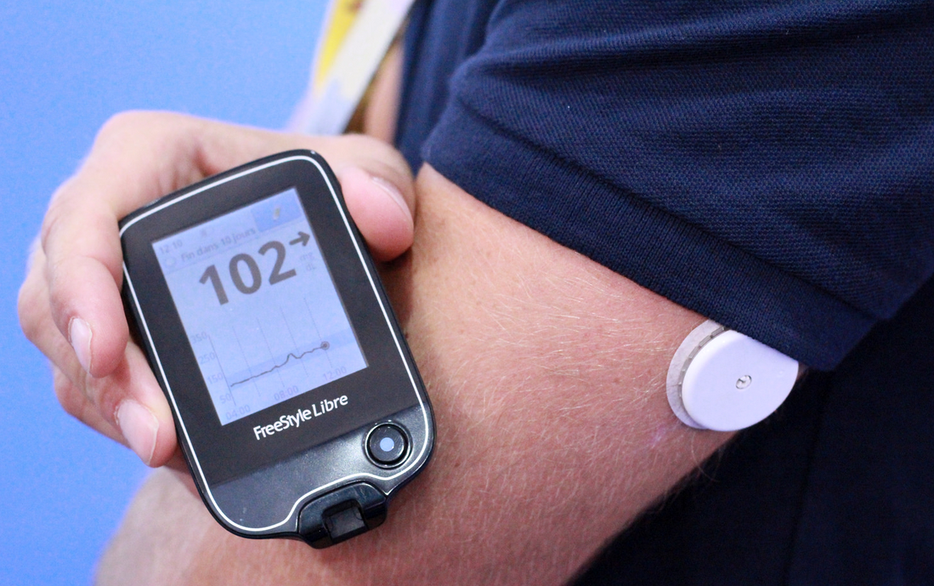
In Europa haben sie kürzlich auch LibreLink eingeführt, eine mobile App, mit der FreeStyle Libre-Nutzer direkt auf ihren Smartphones auf Glukosedaten zugreifen können. Die von AirStrip entwickelte App LibreLink ist die einzige App, die für die Verwendung mit dem FreeStyle Libre-Sensor zugelassen und zertifiziert ist.
Obwohl wir noch immer nicht darüber hinwegkommen können, dass Abbott den FreeStyle Navigator CGM hier in den USA vor Jahren so schlampig eingestellt hat, freuen wir uns, dass Libre eine neue Art von Werkzeug für Menschen mit Behinderung vorstellt. Wir hoffen, bis zum Jahresende deutliche Fortschritte zu erzielen.
Insulinpumpenfortschritt
Was können wir 2016 neben dem Marktführer Medtronic von Insulinpumpenherstellern erwarten?
Tandem Diabetes Care

Insulet / OmniPod
Marketingleiter Christopher Gilbert sagt uns, dass sie ihre PDM prod
ukt an die FDA in der Mitte schicken wollen 2016. "Wir untersuchen auch die Integrationsmöglichkeiten für den G5-Sensor mit dem OmniPod-Gerät. Unsere Marktforschung zeigt, dass Patienten diese Informationen zusammen mit zusätzlichen OmniPod-Informationen wirklich auf ihrem Telefon sehen möchten. Und wir (zusammen mit Dexcom ) evaluieren Wege, die CGM-Integration zu beschleunigen … "
Wir haben auf den großen ADA Scientific Sessions im Juni 2015 einen Prototyp ihres neuen PDMs gesehen, und es gab eine Menge Aufregung in der Kabine von allen, die kamenhalte und spiele damit.Während dies vor ein paar Jahren langsamer als erwartet von den ersten Erwähnungen ist, freuen wir uns zu hören, dass die Einreichung bald kommen wird, und nur vielleicht werden wir die Zulassung der FDA bis zum Jahresende sehen.

JnJ / Lifescan / Animas
Die große Neuheit des letzten Jahres war, dass das Animas Vibe Pump-CGM Combo-Gerät nach vielen Jahren des Wartens endlich auf den Markt kam und wir uns natürlich fragten, ob Updates geplant waren , wie das Starten von Data-Sharing-Tools oder Next-Gen-Integration mit dem G5, wie es Tandem anstrebt.Lifescan Communications Director Dave Detmers sagt, dass unsere D-Community in diesem Jahr zwei besondere Dinge beobachten kann:
Animas Vibe für Kinder:
Sie warten auf die FDA-Zulassung der pädiatrischen Indikation für Animas Vibe. Auch wenn Ärzte dies den Kindern außerhalb des Labels verschrieben haben, wurde dies nicht von der FDA genehmigt und es ist offiziell nur eine Option für Erwachsene.- OneTouch Verio Flex Meter :
- Für dieses Messgerät, das bereits in Kanada und Europa erhältlich ist, wird für das erste Halbjahr 2016 eine Produkteinführung erwartet. Verio Flex ist ein neues Messgerät mit Bluetooth-Anschluss, das ein schlankes, weißes Design, große, leicht lesbare Zahlen und eine dreifarbige Bereichsanzeige aufweist, mit der Sie leicht erkennen können, ob Ihr BG-Ergebnis niedrig, hoch oder in Reichweite ist. Auch während des Gewinnberichts für das zweite Quartal im Juli 2015 stellte J & J Pläne vor, die Calibra Finesse Patch Pump irgendwann im Jahr 2016 zu lancieren. Dies ist ein Bolus-Only, tragbares Insulin Patch-Gerät mit ein sehr schönes Profil, das bis zu drei Tage am Körper getragen werden kann. Es fasst 200 Einheiten schnell wirkendes Insulin und allos PWDs, um Zwei-Einheiten-Boli zu nehmen, indem Knöpfe direkt auf dem Pflaster gedrückt werden, ohne dass eine separate Kontrolleinheit benötigt wird. Diese Patch-Pumpe-Alternative wurde im Jahr 2010 von der FDA sowohl für T1- als auch für T2-Diabetes zugelassen und schließlich von J & J im Jahr 2012 gekauft, aber sie kam nie zustande und schien in Vergessenheit zu geraten … bis jetzt!

Wie wir bereits im Oktober berichtet haben, ist es wahrscheinlich, dass Patienten 2016 Zugang zu einem neuen, stark verbesserten Insulininfusionsset haben werden - eines, das die Unzuverlässigkeit aktueller Sets weitgehend eliminiert.


BD ist ein anerkannter Marktführer bei der Insulinabgabe für Injektionen, aber der BD Flowsmart ist der erste Vorstoß in Pumpeninfusionssets. Dies wird tatsächlich als das Minimed Pro-Set mit BD FlowSmart Technologie auf den Markt kommen, basierend auf BDs Zusammenarbeit mit Medtronic, in der MedT dieses neue BD-made-Set kommerzialisieren wird.
Mehr als 20 Arten von Infusionssets gibt es auf dem Markt, aber Tatsache ist, dass Okklusionsfehler weit verbreitet sind.Flowsmart zielt darauf ab, diese Fehler mit einem zweiten Seitenanschluss zu reduzieren, der einen alternativen Weg für Insulin ermöglicht, sowie einen schwenkbaren Schlauchanschluss und eine spezielle Art von Niederdruck-Infusionstechnologie, um Blockaden zu reduzieren. Es bietet auch den kleinsten auf dem Markt erhältlichen Katheter.Während BD kein bestimmtes Startdatum mitgeteilt hat, sagte Dr. Aaron Kowalski von JDRF, dass dies Anfang 2016 passieren könnte und BD bestätigt, dass es einen erwarteten Start für 2016 plant.
Glucagon Up Your NoseBis zum Ende des Jahres ist es möglich, dass wir einen Glukagonpulver in der Nase schnüffeln können, um den Blutzucker im Notfall schneller zu erhöhen.
Eine aufregende Nachricht kam im Oktober, als Eli Lilly den neuen Nasenglucagon Locemia erwarb (ein intelligenter Name, der Low und Hypoglykämie kombiniert). Dies ist natürlich eine revolutionäre Verbesserung gegenüber den aktuellen Glucagon-Notfallkits mit ihren komplexen und einschüchternden Anweisungen zur Gemischmischung.

umfassend Lymphemia behandelt, einschließlich meiner eigenen klinischen Erfahrung im Jahr 2014.
Ursprünglich hatte Lacemia darüber gesprochen, dies bis Mitte 2016 bei der FDA einzureichen anzunehmen, dass Lilly genau diesen Zeitplan einhalten wird - insbesondere, da die Phase-III-Studien nun abgeschlossen sind. Lilly-Sprecherin Julie Williams erklärt uns: "Wir arbeiten hart daran, sicherzustellen, dass die Einreichung neuer Arzneimittelanträge durch ein robustes klinisches Paket und eine zuverlässige Lieferkettenstrategie unterstützt wird. Sobald diese Elemente vorhanden sind, freuen wir uns auf die Einreichung von Zulassungsanträgen." OK gut! Zweifellos wird 2016 auf der Forschungsseite, bei der Datenweitergabe und der Closed-Loop-Technologie usw. viel mehr passieren. Außerdem wird die ständig wachsende Welt der mobilen Gesundheit uns sicherlich mehr bringen Aufregung im Jahr 2016, kein Zweifel. Was oben aufgeführt ist, können wir in der Produktwelt zählen.
Sagen Sie uns, Diabetes-Freunde: Was haben Sie für 2016 im Visier?
Disclaimer
: Inhalt, der vom Team der Diabetes Mine erstellt wurde. Für mehr Details klicken Sie hier.
Haftungsausschluss
Dieser Inhalt wurde für Diabetes Mine erstellt, ein Verbrauchergesundheitsblog, der sich auf die Diabetes-Community konzentriert. Der Inhalt wird nicht medizinisch überprüft und entspricht nicht den redaktionellen Richtlinien von Healthline. Für weitere Informationen über die Partnerschaft von Healthline mit der Diabetes Mine, klicken Sie bitte hier.Aloe Vera für das Haar: Vorteile für das Haarwachstum

Wie man ein Wellness-Mantra für das neue Jahr erstellt

Eine Situation mit hohem Stressfaktor lehrte mich, dass ich ein Mantra brauchte, das mir helfen könnte, schwierige Zeiten zu meistern.
Diabetes Jahr im Rückblick 2016 | DiabetesMine

DiabetesMine denkt über die großen Diabetes-Neuigkeiten von 2016 nach, einschließlich der jüngsten Entscheidung der FDA, dass Dexcom G5 für die Insulindosierung verwendet werden kann.



